Effect of photodynamic therapy on biofilm formation of drug-resistant Acinetobacter baumannii
-
摘要目的
探索碘化钾(KI)联合亚甲基蓝(MB)介导的抗菌光动力疗法(aPDT)对多重耐药鲍曼不动杆菌(MDRAb)及广泛耐药鲍曼不动杆菌(XDRAb)生物膜形成的影响。
方法以MDRAb、XDRAb菌株为实验对象,在10 J/cm2光能量密度照射下,亚致死量的aPDT对MDRAb、XDRAb进行不同次数的光动力干预。通过结晶紫半定量法测定aPDT干预不同次数耐药菌生物膜形成。比较aPDT对MDRAb、XDRAb不同干预次数之间生物膜的表达量,探索KI联合MB介导的aPDT对耐药鲍曼不动杆菌生物膜形成的影响。
结果在10 J/cm2光能量密度照射下,亚致死量的aPDT对MDRAb、XDRAb进行多次干预后,生物膜表达量较干预前显著下降(P<0.05),干预7次比干预1次生物膜表达量显著下降(P<0.001),干预1次与干预4次、干预4次与干预7次相比生物膜表达量无明显下降(P>0.05)。
结论KI联合MB介导的aPDT使耐药鲍曼不动杆菌的生物膜的形成能力下降,aPDT连续干预7次可显著抑制耐药菌的生物膜形成能力,可减少耐药菌的体外生物膜形成量。
AbstractObjectiveTo explore the effect of potassium iodide (KI) combined with methylene blue (MB)-mediated antimicrobial photodynamic therapy (aPDT) on the biofilm formation of multidrug-resistant Acinetobacter baumannii (MDRAb) and extensively drug-resistant Acinetobacter baumannii (XDRAb).
MethodsMDRAb strains and XDRAb strains were selected as experimental objects. Under the irradiation of 10 J/cm2 light energy density, sublethal aPDT was applied to MDRAb and XDRAb for different times of photodynamic intervention. The biofilm formation of drug-resistant bacteria was determined with aPDT intervention by crystal violet semiquantitative method. The effect of KI combined with MB-mediated aPDT on biofilm formation of DRAb was explored by comparing the expression levels of aPDT on MDRAb and XDRAb at different intervention times.
ResultsUnder the irradiation of 10 J/cm2 light energy density, the biofilm expression levels of MDRAb and XDRAb after multiple interventions with sublethal dose of aPDT were significantly decreased compared with those before intervention (P < 0.05), and the biofilm expression levels after intervention for seven times were significantly decreased compared with single intervention (P < 0.001). The expression level of biofilm after single intervention was not significantly decreased compared with that after four consecutive times intervention, nor was there a significant decrease when comparing four consecutive times with seven consecutive times intervention (P > 0.05).
ConclusionKI combined with MB-mediated aPDT can decrease the biofilm formation ability of DRAb. Seven consecutive times intervention can significantly inhibit the biofilm formation ability of drugresistant bacteria, and reduce the biofilm formation amount of drug-resistant bacteria in vitro.
-
鲍曼不动杆菌(Acinetobacter baumannii, Ab)是引起医院内感染的重要病原菌,对危重患者和重症监护病房中的患者危害大[1], 在医院环境中感染Ab可导致26%的死亡率,而在重症监护病房中增加到43%[2]。Ab耐药率逐年上升,多重耐药Ab(multidrug-resistant Ab, MDRAb),尤其广泛耐药Ab(extensively drug-resistant Ab, XDRAb)的出现可用的抗生素很少[3],使得临床治疗面临挑战。生物膜的形成是Ab耐药的主要机制之一[4],而且也是60%~80% 感染产生的原因[5]。此外,生存于生物膜中的病原微生物由于生物膜赋予的特殊防御机制而表现出内在抗性,比浮游菌对抗菌剂的抵抗力高1 000倍[6]。
抗菌光动力疗法(antimicrobial photodynamic therapy, aPDT)是特定波长的激发光与光敏剂(photosensitizer, PS)在有氧环境下结合生成具有杀伤作用的高活性氧(reactive oxygen species,ROS),如单线态氧(1O2),作用于细胞的蛋白质、DNA、RNA、脂质等不同结构,从而杀死病原微生物[7]。此外,aPDT杀菌过程不产生耐药性[8]。亚甲基蓝(methylene blue, MB)是被美国食品及药物管理局(food and drug administration, FDA)批准用于临床的能产生高量子产率单线态氧的光敏剂[9]。本研究旨在探索碘化钾(potassium iodide, KI)联合MB介导的aPDT对耐药Ab生物膜形成的影响,为临床应对耐药Ab的治疗提供参考。
1. 材料与方法
1.1 研究对象
以来自临床患者的外周血和痰标本,经广西医科大学第一附属医院检验科微生物室分离鉴定的1株MDRAb菌株和1株XDRAb菌株作为实验对象,分别编号为MDRAb272、XDRAb46064。
1.2 主要试剂及仪器
脑心浸液肉汤(brain heartinfusion broth, BHI,北京陆桥技术股份有限公司)、MB(美国Sigma公司)、KI(四川成都市科隆有限公司)、胰蛋白胨大豆肉汤(tryptone soy broth, TSB, 北京陆桥技术有限公司)、磷酸盐缓冲液(phosphate- buffered saline, PBS, 合肥博美生物科技有限公司)、660 nm LED灯(light emitting- diode, 美国LumaCara公司)。
1.3 细菌悬液的制备
以MDRAb272、XDRAb46064为实验对象,将单个菌落悬浮于BHI培养液中,在通气条件下,置于200 r/min、37 ℃的摇床培养箱中过夜培养。吸取1 mL过夜菌悬液加入新鲜BHI培养液中继续培养,2~3.5 h达对数期,制备浓度108 CFU /mL(测定OD600=0.6~0.8)的菌悬液。
1.4 KI联合MB介导的aPDT对耐药菌亚致死量的测定
同“1.3项”制备XDRAb菌悬液,进行aPDT干预实验,本实验设空白对照组、单纯KI光照组、单纯KI暗对照组、MB+KI暗对照组、光动力组5组。(1)空白对照组:菌液+PBS,无光照;(2)单纯KI光照组:菌液+KI,光照;(3)单纯KI暗对照组:菌液+KI,无光照;(4)MB+KI暗对照组:菌液+MB+KI,无光照;(5)光动力组:菌液+MB+KI,光照;光照组的光能量密度均为10 J/cm2。KI的终浓度分别为0 mmol/L、10 mmol/L、25 mmol/L、40 mmol/L、55 mmol/L,MB终浓度固定为0.75 μmol/L。每组均需充分混匀避光孵育30 min后再按条件处理,结束后梯度稀释10-1~10-6倍,取稀释液接种于BHI琼脂培养基,37 ℃避光培养10~16 h。观察并计算菌落形成单位(colony-forming units, CFU)及存活率。杀菌效果判定依据[10]:存活率下降<99.9%(<3logs)为无效杀菌;存活率下降≥99.9%(≥3logs)为有效杀菌;存活率下降≥99.999%(≥5logs)为高效杀菌。每组实验设3个平行对照,每个实验重复不少于3次。
1.5 细菌存活率计算方法
$$ \text { 细菌存活率 }(\%)=\frac{\text { 实验组细菌菌落数 }}{\text { 空白对照组细菌菌落数 }} \times 100 \% $$ 1.6 KI联合MB介导的aPDT对耐药菌株的多次干预
根据Cassidy等[11]研究,aPDT对细菌的亚致死条件定义为菌量减少0.5~2log10。本实验根据“1.4项”结果选择能清除99%(即2log10)菌量的光动力影响为亚致死量的光动力参数。亚致死量的光动力参数作为对MDRAb272和XDRAb46064多次干预的光动力参数。同“1.3项”制备菌悬液,同“1.4项”对MDRAb272、XDRAb46064进行多次干预。将干预0次、1次、4次、7次的MDRAb272、XDRAb46064的菌落拟制备生物膜。
1.7 aPDT干预前、后耐药菌株体外生物膜的制备
参照文献[12],分别将aPDT干预0次、1次、4次、7次的MDRAb272、XDRAb46064的单个菌落悬浮于TSB培养液中,同“1.3项”制备108 CFU/mL的菌悬液。按照1∶100比例将菌液稀释,在96孔板每孔内加入稀释后菌液0.2 mL,放入37 ℃培养箱静置培养24 h。将无菌培养液的孔设为阴性对照孔。每个样本重复3次,每次3个复孔。
1.8 结晶紫染色半定量法测定aPDT干预前、后耐药菌的生物膜形成能力
待生物膜形成,弃多余TSB培养液,PBS洗涤3次,弃PBS后在室温下晾干、固定。0.1%结晶紫染液染色5 min,超纯水轻柔洗涤去除未结合的结晶紫染液,33% 乙酸溶液溶解,取溶解有结晶紫的乙酸溶液到新的96孔板中。酶标仪测定570 nm处吸光度值(A570),评估生物膜的表达量。用A570(x)表示菌株的测定值,每株菌的A570(x)等于3个复孔的均值减去空白对照孔,A570(-)表示阴性对照组的值,每个样本重复3次, 每次3个复孔。根据细菌生物膜吸光度测定的均值和阴性对照的值来判断生物膜形成能力强度[13]:A570(x)≤2A570(-)表示生物膜形成能力阴性,2A570(-)<A570(x)≤4A570(-)表示生物膜形成能力弱阳性,A570(x)>4A570(-)表示生物膜形成能力强阳性。
1.9 统计学方法
采用SPSS 26.0统计软件对KI联合MB对浮游菌的抗菌效果、生物膜A570进行数据处理,计量资料使用单因素方差分析,多组间两两比较使用LSD-t检验,以P<0.05为差异具有统计学意义。
2. 结果
2.1 KI联合MB介导的aPDT对耐药菌亚致死量的测定
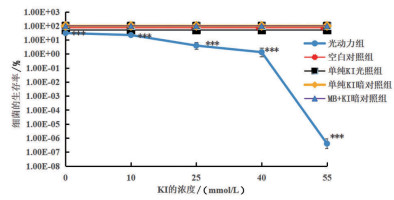
当光能量密度为10 J/cm2,MB终浓度为0.75 μmol/L,加入KI终浓度分别为0 mmol/L、10 mmol/L、25 mmol/L、40 mmol/L、55 mmol/L时,aPDT处理后XDRAb46064的存活率分别为30.77%、22.30%、3.94%、1.34%、0.000 000 404%。光动力组的细菌存活率随着KI浓度增大呈现下降趋势,即KI联合MB介导的aPDT杀菌效果随KI浓度增大而增强。当KI终浓度为0 mmol/L、10 mmol/L、25 mmol/L、40 mmol/L、55 mmol/L时,光动力组与空白对照组、单纯KI光照组、单纯KI暗对照组、MB+KI暗对照组之间差异有统计学意义(P<0.000 1)。终浓度40 mmol/L KI联合终浓度0.75 μmol/L MB清除细菌量接近99%,该浓度组合的光动力影响认定为亚致死量,见图 1。
2.2 结晶紫半定量法测定耐药菌生物膜形成能力
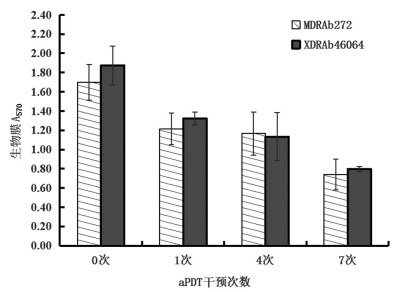
亚致死量的aPDT对XDRAb46064和MDRAb272进行0次、1次、4次、7次干预后通过结晶染色半定量法测定生物膜的形成能力。从XDRAb46064和MDRAb272在570 nm处的生物膜A570的结果显示,在相同干预条件下两株菌相同干预次数之间A 570比较,差异无统计学意义(P>0.05),见图 2。
2.3 aPDT干预不同次数对MDRAb生物膜形成的影响
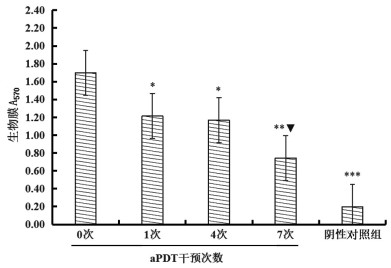
aPDT干预MDRAb272 0次(即MDRAb272干预前),与干预1次、干预4次、干预7次、阴性对照组生物膜A570比较,差异均有统计学意义(均P<0.05);aPDT干预1次与干预4次生物膜A570比较,差异无统计学意义(P>0.05),与干预7次生物膜A570比较,差异有统计学意义(P<0.001);aPDT干预4次与干预7次生物膜A570比较,差异无统计学意义(P>0.05),见图 3。
2.4 aPDT干预不同次数对XDRAb生物膜形成的影响
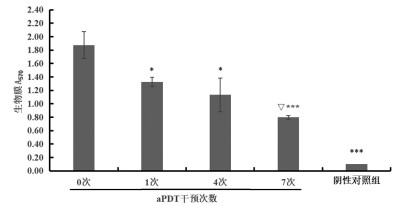
aPDT干预XDRAb46064 0次(即XDRAb46064干预前),与干预1次、干预4次、干预7次、阴性对照组生物膜A570比较,差异均有统计学意义(均P<0.05);aPDT干预1次与干预4次生物膜A570比较,差异无统计学意义(P>0.05),与干预7次生物膜A570比较差异有统计学意义(P<0.001);aPDT干预4次与干预7次的生物膜A570比较,差异无统计学意义(P>0.05),见图 4。
3. 讨论
细菌生物膜是附着于生物或非生物表面的细菌群落及其自身分泌的胞外多糖基质的聚集[14]。在体外培养下大约24 h生物膜便可以形成,共包括5个阶段:可逆黏附、不可逆附着、微集落形成、定植或成熟、扩散[15]。有研究发现在烧伤患者中,超过90%的Ab菌株产生生物膜,从而导致了抗生素耐药率的增加[16]。因此,面对耐药菌的治疗挑战,抗生物膜的治疗显得尤为重要。aPDT可影响多种生物膜的靶点,比如脂质、细胞外聚合物、蛋白质和DNA。PS光激活后产生的ROS可损伤细胞内外的细菌、生物膜基质临近的细菌[7, 14]。
本研究中,在光能量密度为10 J/cm2的LED灯照射下,终浓度55 mmol/L KI联合终浓度0.75 μmol/L MB介导的aPDT对XDRAb浮游菌即可达到99.999% 高效杀菌。研究结果表明,aPDT对耐药Ab浮游菌在体外具有杀伤作用。此外,本研究还探索了亚致死量的aPDT对耐药Ab生物膜形成的影响,结果表明亚致死量的aPDT可以抑制MDRAb和XDRAb强生物膜产生菌的生物膜形成能力,并且增加干预次数可以增强抑制效果。多次亚致死量的aPDT可能增加了细菌对光动力治疗的敏感性,从而降低细菌的生物膜形成能力。Buchovec等[17]发现核黄素和无铜叶绿素钠盐介导的aPDT对Ab浮游菌和生物膜的形成有抑制作用。这与本研究aPDT对耐药Ab浮游菌和生物膜形成的影响结果相似,该研究小组在实验中发现126 J/cm2的光能量密度下110 μmol/L核黄素介导的aPDT抗生物膜能力下降了8倍,而150 μmol/L无铜叶绿素钠盐介导的aPDT仅下降1.9倍。Otieno等[18]报道了竹红菌乙素介导的aPDT对多种耐药革兰阳性菌及阴性菌的浮游菌、生物膜均有抑制作用。这与本研究结果类似。但Chan等[19]报道MB介导的aPDT对大肠杆菌、粪肠球菌、耐甲氧西林金黄色葡萄球菌、肺炎克雷伯菌的生物膜形成能力影响效果不理想。与本研究不同,原因可能为aPDT干预次数不同,此外,aPDT对生物膜形成和浮游菌的影响取决于多种因素,如与PS种类、PS浓度、细菌种类、光照条件、有无添加协同作用物质等有关。而在本研究中除有光敏剂MB外还添加了增强MB作用的KI,KI是一种无毒无机盐,安全性好,在aPDT杀菌过程中,加入KI后,I ̄与 1O2反应可产生半衰期较短的对细菌细胞有毒性的活性物质,如活性碘自由基(I•或I2• ̄),以及产生半衰期较长的有抗菌作用的游离碘(I2 /I3 ̄)[20]。因此,aPDT治疗过程中,添加KI后不仅可以通过活性碘自由基来增强杀菌作用,同时也可以通过产生的长期稳定的抗菌物质来阻止细菌的复发及再生,从而延长杀菌效果持续的时间。KI联合MB在体外和感染的动物模型中均显示出Ab、大肠杆菌、金黄色葡萄球菌的数量显著减少,且大大减少aPDT治疗时间、光敏剂所需的浓度以及光能量密度[2]。Benine-Warlet等[21]报道了KI联合MB介导的aPDT显著降低了变形链球菌生物膜的活力,这与本研究结果相似。因此,aPDT在应用于临床耐药菌生物膜感染的治疗时可以联合KI增强抗菌效果,也可以连续多次的aPDT治疗以增加疗效。Zhang等[22]在aPDT对耐多粘菌素大肠杆菌的体外研究中证实了多次亚致死量aPDT不会产生耐药性,且可影响耐药菌株的重要基因和毒力因子及致部分抗菌素的最低抑菌浓度(minimum inhibitory concentration, MIC)下降。耐药菌株基因及毒力因子的改变可能是多次亚致死量aPDT能抑制生物膜形成的原因之一。由此可见,aPDT作为抗菌治疗方法有其独特的优势。
综上所述,KI联合MB介导的aPDT对强生物膜生产的MDRAb和XDRAb的生物膜形成能力有抑制作用,并且增加aPDT的干预次数可以增加抑制生物膜的效果。因此,KI联合MB介导的aPDT具有预防微生物生物膜形成的潜力或者成为一种抗菌治疗的方法。此外,aPDT作为局部感染的治疗方法有望得到广泛运用。但是,尚需要大量MDRAb、XDRAb菌株实验以及体内实验来进一步验证,以期为临床的实际运用提供足够的理论基础。
-
[1] IOVLEVA A, MUSTAPHA M M, GRIFFITH M P, et al. Carbapenem-resistant Acinetobacter baumannii in U. S. hospitals: diversification of circulating lineages and antimicrobial resistance[J]. mBio, 2022, 13(2): e0275921. doi: 10.1128/mbio.02759-21
[2] ASIF M, ALVI I A, REHMAN S U. Insight into Acinetobacter baumannii: pathogenesis, global resistance, mechanisms of resistance, treatment options, and alternative modalities[J]. Infection and drug resistance, 2018, 11: 1249-1260. doi: 10.2147/IDR.S166750
[3] NICHOLS L. Death from pan-resistant superbug[J]. Autopsy & case reports, 2019, 9(3): e2019106.
[4] SHI J C, CHENG J H, LIU S R, et al. Acinetobacter baumannii: an evolving and cunning opponent[J]. Frontiers in microbiology, 2024, 15: 1332108. doi: 10.3389/fmicb.2024.1332108
[5] AL-AHMAD A, BUCHER M, ANDERSON A C, et al. Antimicrobial photoinactivation using visible light plus water-filtered infrared-A (VIS + wIRA) alters in situ oral biofilms[J]. PLoS one, 2015, 10(7): e0132107. doi: 10.1371/journal.pone.0132107
[6] URUÉN C, CHOPO-ESCUIN G, TOMMASSEN J, et al. Biofilms as promoters of bacterial antibiotic resistance and tolerance[J]. Antibiotics, 2020, 10(1): 3. doi: 10.3390/antibiotics10010003
[7] MORO M G, DE CARVALHO V F, GODOY-MIRANDA B A, et al. Efficacy of antimicrobial photodynamic therapy (aPDT) for nonsurgical treatment of periodontal disease: a systematic review[J]. Lasers in medical science, 2021, 36(8): 1573-1590. doi: 10.1007/s10103-020-03238-1
[8] CRAIG R A, MCCOY C P, GORMAN S P, et al. Photosensitisers-the progression from photodynamic therapy to anti-infective surfaces[J]. Expert opinion on drug delivery, 2015, 12(1): 85-101. doi: 10.1517/17425247.2015.962512
[9] TOUM TERRONES Y, TORRESÁN M F, MIRENDA M, et al. Photoactive red fluorescent SiO2 nanoparticles based on controlled methylene blue aggregation in reverse microemulsions[J]. Langmuir, 2022, 38(22): 6786-6797. doi: 10.1021/acs.langmuir.1c02458
[10] ALVES E, COSTA L, CARVALHO C M, et al. Charge effect on the photoinactivation of Gram-negative and Grampositive bacteria by cationic meso-substituted porphyrins [J]. BMC microbiology, 2009, 9: 70. doi: 10.1186/1471-2180-9-70
[11] CASSIDY C M, DONNELLY R F, TUNNEY M M. Effect of sub-lethal challenge with photodynamic antimicrobial chemotherapy (PACT) on the antibiotic susceptibility of clinical bacterial isolates[J]. Journal of photochemistry and photobiology B, biology, 2010, 99(1): 62-66. doi: 10.1016/j.jphotobiol.2010.02.004
[12] STEPANOVIC S, VUKOVIC D, DAKIC I, et al. A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J]. Journal of microbiological methods, 2000, 40(2): 175-179. doi: 10.1016/S0167-7012(00)00122-6
[13] 江培涛, 方敏, 刘棵文, 等. 生物膜抑制剂对泛耐药鲍曼不动杆菌碳青霉烯类耐药性的影响[J]. 中国抗生素杂志, 2018, 43(10): 1291-1295. [14] SONGCA S P, ADJEI Y. Applications of antimicrobial photodynamic therapy against bacterial biofilms[J]. International journal of molecular sciences, 2022, 23(6): 3209. doi: 10.3390/ijms23063209
[15] BISWAS I, METTLACH J. A simple static biofilm assay for Acinetobacter baumannii[J]. Methods in molecular biology, 2019, 1946: 159-165.
[16] SALMANI A, SHAKERIMOGHADDAM A, PIROUZI A, et al. Correlation between biofilm formation and antibiotic susceptibility pattern in Acinetobacter baumannii MDR isolates retrieved from burn patients[J]. Gene reports, 2020, 21: 100816. doi: 10.1016/j.genrep.2020.100816
[17] BUCHOVEC I, VYČAITĖ E, BADOKAS K, et al. Application of antimicrobial photodynamic therapy for inactivation of Acinetobacter baumannii biofilms[J]. International journal of molecular sciences, 2022, 24(1): 722. doi: 10.3390/ijms24010722
[18] OTIENO W, LIU C C, DENG H, et al. Hypocrellin Bmediated photodynamic inactivation of gram-positive antibiotic-resistant bacteria: an in vitro study[J]. Photobiomodulation, photomedicine, and laser surgery, 2020, 38(1): 36-42. doi: 10.1089/photob.2019.4656
[19] CHAN H, PAVELKA M S J R, BARAN T M. Methylene blue photodynamic therapy of bacterial species found in human abscesses: Planktonic, biofilm, and 3D silicone models[J]. Proceedings of SPIE-the international society for optical engineering, 2023, 12358: 1235805.
[20] PRADO-SILVA L D, GOMES A T P C, MESQUITA M Q, et al. Antimicrobial photodynamic treatment as an alternative approach for Alicyclobacillus acidoterrestris inactivation[J]. International journal of food microbiology, 2020, 333: 108803. doi: 10.1016/j.ijfoodmicro.2020.108803
[21] BENINE-WARLET J, BRENES-ALVARADO A, STEINER-OLIVEIRA C. Potassium iodide enhances inactivation of Streptococcus mutans biofilm in antimicrobial photodynamic therapy with red laser[J]. Photodiagnosis and photodynamic therapy, 2022, 37: 102622. doi: 10.1016/j.pdpdt.2021.102622
[22] ZHANG M M, CUI Z X, WANG Y L, et al. Effects of sublethal antimicrobial photodynamic therapy mediated by haematoporphyrin monomethyl ether on polymyxin-resistant Escherichia coli clinical isolate[J]. Photodiagnosis and photodynamic therapy, 2021, 36: 102516. doi: 10.1016/j.pdpdt.2021.102516





 下载:
下载: