Effect of gnetol on osteoporotic bone defect mice based on RANKL/RANK/TRAF6 and gut microbiota
-
摘要目的
探索买麻藤醇治疗骨质疏松性骨缺损的潜在机制和对肠道菌群的影响。
方法将30只C57BL/6J小鼠随机分为假手术组、模型组、阿仑膦酸钠组、低剂量买麻藤醇组以及高剂量买麻藤醇组。通过双侧卵巢摘除术构建骨质疏松模型,后在此模型上使用脂多糖(LPS)构建颅骨缺损模型。使用Micro-CT和苏木精—伊红染色(HE)观察小鼠颅骨骨密度和骨微结构,使用酶联免疫吸附试验(ELISA)检测血清中肿瘤坏死因子-α(TNF-α)和Ⅰ型胶原交联羧基端肽(CTX-I)的表达,实时荧光定量PCR(RT-qPCR)检测组织蛋白酶K(CTSK)的表达,蛋白质免疫印迹法检测NFATc1、c-fos、TNF-α、TRAP、CTSK、RANK、TRAF6、RANKL、p-p65、p-IκBα的表达,16sRNA测序检测假手术组、模型组和高剂量买麻藤醇组的肠道菌群丰度。
结果与假手术组相比,模型组小鼠颅骨BMD和骨微结构破坏明显,TRAP、CTSK、CTX-Ⅰ、TNF-α、c-Fos、NFATc1、破骨细胞分化通路(RANK、RANKL、TRAF6)和炎症通路(p-P65、p-IκBα)蛋白表达量提高,骨吸收标志物CTSK基因表达提高,肠道丰富度提高,正常肠道菌群群落结构破坏。买麻藤醇改善了骨质疏松状态下LPS导致的骨微结构受损和骨丢失现象,抑制对破骨细胞分化起促进作用的TNF-α、c-Fos和NFATc1、破骨细胞分化通路(RANK、RANKL、TRAF6)和炎症通路(p-P65、p-IκBα)的蛋白表达,降低CTSK基因表达;降低对骨组织起到负面作用的毛螺菌科、另枝菌属等有害菌的丰度,并提高丹毒丝菌科以及双歧杆菌科(包括双歧杆菌属)等有益菌属的丰度。
结论买麻藤醇有效改善了骨质疏松状态下LPS导致的骨微结构破坏和机体过强的骨吸收,下调RANKL/RANK/TRAF6信号通路的表达和抑制NF-κB信号通路的激活,并调节有益菌和有害菌的丰度。
-
关键词
- 买麻藤醇 /
- 破骨细胞 /
- 骨质疏松性骨缺损 /
- RANK/RANKL/TRAF6信号通路 /
- 肠道菌群
AbstractObjectiveTo explore the potential mechanism of gnetol in the treatment of osteoporotic bone defects and its effect on the gut microbiota.
MethodsA total of 30 C57BL/6J mice were randomly divided into sham group, model group, alendronate sodium group, low-dose gnetol group, and high-dose gnetol group. An osteoporosis model was constructed by bilateral ovarian enucleation, and then a skull defect model was constructed using lipopolysaccharide (LPS) on this model. Micro-CT and hematoxylin-eosin (HE) staining were used to observe the bone mineral density and bone microstructure of the skull of mice, the expression of tumor necrosis factor- α (TNF-α) and C-terminal telopeptide of type Ⅰ collagen (CTX-I) in the serum was detected by enzyme-linked immunosorbent assay (ELISA), the expression of cathepsin K (CTSK) was detected by reverse transcriptionquantitative polymerase chain reaction (RT-qPCR), and the expression of NFATc1, c-fos, TNF-α, TRAP, CTSK, RANK, TRAF6, RANKL, p-p65 and p-IκBα was detected by western blotting. The abundance of gut microbiota in the sham, model and high-dose groups was detected by 16sRNA sequencing.
ResultsCompared with the sham group, the BMD and bone microstructure of the skull in the model group were significantly damaged. The protein expression levels of TRAP, CTSK, CTX-I, TNF-α, c-Fos, NFATc1, as well as those related to the osteoclast differentiation pathway (RANK, RANKL, TRAF6), inflammatory pathway (p-P65 and p-IκBα) were increased, and the expression of bone resorption marker CTSK gene was also increased. Moreover, the gut microbiota richness was increased, while the structure of the normal gut microbiota community was disrupted. Gnetol ameliorated impaired bone microarchitecture and bone loss caused by lipopolysaccharide (LPS) in osteoporotic states, inhibited the protein expression of TNF-α, c-Fos and NFATc1 which promote osteoclast differentiation, as well as the protein expression of the osteoclast differentiation pathways (RANK, RANKL, TRAF6) and inflammatory pathways (p-P65, p-IκBα), and reduced the gene expression of CTSK. It reduced the abundance of harmful bacteria such as Lachnospiraceae and Alistipes that have a negative impact on bone tissue, and increased the abundance of beneficial bacteria such as Erysipelothrichaceae, and Bifidobacteriaceae (including Bifidobacterium).
ConclusionGnetol effectively ameliorates bone microstructural disruption and excessive bone resorption in the body due to LPS in osteoporotic states. It down-regulates the expression of the RANKL/RANK/TRAF6 signaling pathway, inhibits the activation of the NF-κB signaling pathway, and regulates the abundance of both beneficial and harmful bacteria.
-
随着人口老龄化和生活方式的改变,雌激素缺乏导致的骨质疏松症的患病率逐年增加[1]。针对中国由于雌激素缺乏导致的骨质疏松症的流行病学研究表明,年龄≥40岁绝经后妇女骨质疏松症的患病率高达32.5%[2]。骨质疏松症为退行性疾病,其病理特征为骨吸收大于骨形成并导致骨密度降低和骨微结构恶化[3-4],在该病理状态下骨缺损等骨损伤发生率显著提高。由于骨缺损愈合困难且易出现预后不良,需加强对其发病机制和治疗手段的研究,以改善骨质疏松性骨缺损患者的生活质量。
买麻藤醇提取自买麻藤属植物[5],该属植物在亚洲传统医学中被广泛应用于关节炎以及支气管炎等炎症性疾病中[6-7]。药理研究表明,买麻藤醇具有抗炎、抗癌以及抗氧化等药理活性[8-10]。在一项关于买麻藤醇代谢物的体外抗炎活性研究中发现,买麻藤醇的葡萄糖醛酸苷代谢物在体外具有显著的抑制脂多糖(LPS)刺激的小鼠巨噬细胞中白细胞介素-1β(IL1-β)和肿瘤坏死因子-α(TNF-α)产生与释放的活性[11],表明买麻藤醇的抗炎活性部分由其代谢物介导。买麻藤作为治疗骨折脱位的中药复方正骨水的组成部分而被记载于《中国药典》中[12],表明该属植物对骨缺损相关疾病有一定的治疗潜力。然而,买麻藤的醇提物买麻藤醇对炎症和骨质疏松性骨缺损的治疗研究未见报道。本研究从RANKL/RANK/TRAF6信号通路和肠道菌群的角度探讨了买麻藤醇对骨质疏松性骨缺损中炎性微环境的影响和机制。
1. 材料与方法
1.1 动物分组及处理
8~10周龄的雌性C57BL/6J小鼠购买自广西医科大学实验动物中心,饲养在无特定病原体条件下,保持在标准实验室条件下:(25±2)℃,(50±5)% 湿度,12 h/12 h光暗循环。适应环境1周后,将小鼠随机分成5组,每组6只:假手术组、模型组、阿仑膦酸钠组、低剂量买麻藤醇组和高剂量买麻藤醇组。采用双侧去卵巢(OVX)法建立绝经后骨质疏松模型,在使用0.2 mL/10 g的阿佛丁腹腔注射麻醉小鼠后,找到小鼠的双侧卵巢并进行切除,除假手术组其他组均接受卵巢切除术,假手术组暴露卵巢但不切除。在卵巢摘除术后12周后建立LPS诱导的颅骨缺损模型,将溶于生理盐水的LPS(10 mg/kg)皮下注射至除假手术组外所有组小鼠的颅中缝,假手术组于颅中缝注射100 μL生理盐水。隔天注射LPS,连续28 d。阿仑膦酸钠组、低剂量买麻藤醇组和高剂量买麻藤醇组在注射LPS后1 d分别开始口服阿仑膦酸钠(3 mg/kg)、低剂量买麻藤醇(100 mg/ kg)和高剂量买麻藤醇(200 mg/kg),隔日给药直至实验结束。本实验已通过广西医科大学动物实验福利伦理审查(批准编号:202310017)。
1.2 药品与主要试剂
HPLC纯度≥97.00% 的买麻藤醇购自上海麦克林生化科技股份有限公司;4% 多聚甲醛购自白鲨公司;LPS(L2880-100MG)购自Sigma公司;乙二胺四乙酸(EDTA)购自Thermo Fisher Scientific;Swe‐ Script一步法RT-PCR试剂盒(货号:G3335-50, Wu‐ han Saiweier Biotechnology Co., Ltd)。
1.3 Micro-CT重建与分析
给药周期结束后取小鼠颅骨,使用4% 多聚甲醛固定3~5 d,使用Micro-CT扫描仪(SkyScan1176,Bruker)对小鼠颅骨进行扫描。扫描参数如下:使用SkyScan NRecon,源电压50 kV,源电流500 μA,像素大小9 μm,AI滤波器0.5 mm,旋转步长180°。使用CT扫描仪自带软件进行三维重建。在三维图像重建后,选择颅骨中缝周围的感兴趣区(ROI)并使用CTvox软件对CT图像进行分析。
1.4 苏木精—伊红染色法(HE染色)
取颅骨和胫骨于4% 多聚甲醛固定。使用10% EDTA对颅骨进行脱钙3周,然后进行石蜡包埋。后续对骨组织进行HE和TRAcP染色,作形态学检查,使用高质量显微镜获取切片照片。
1.5 酶联免疫吸附检测(ELISA检测)TNF-α和Ⅰ型胶原交联羧基端肽(CTX-I)水平
使用心脏采血法收集小鼠血液于离心管中。室温静置30 min,在4 ℃、3 000 r/min下离心15 min后收集上层清液,于-80 ℃环境中保存。按照说明书使用TNF- α和CTX-I试剂盒定量检测血清中TNF-α和CTX-I浓度。
1.6 实时荧光定量PCR(RT-qPCR)检测组织蛋白酶K(CTSK)相对表达水平
使用RNAiso Plus试剂(9109,TaKaRa)提取股骨中的总RNA,逆转录试剂盒(SweScript一步法RT-qPCR试剂盒,G3335-50)将RNA转化为cDNA并测定买麻藤醇对小鼠股骨中基因表达的影响。每个反应的总体积为96孔板中的20 μL。每个RTqPCR反应包括10 μL SYBR Green Master Mix、8 μL无菌水和0.5 μL正向和反向引物、1 μL cDNA。qPCR条件程序设置为40个循环,每个循环为95 ℃ 2 min,95 ℃ 30 s,60 ℃ 30 s。使用2−△△CT方法进行数据统计分析。
1.7 蛋白质免疫印迹法(western blotting)检测骨吸收标志物、RANKL/RANK/TRAF6信号通路及下游信号通路NF-κB相关蛋白表达
将小鼠胫骨样本在液氮中研磨成细粉状,使用含有0.1% 蛋白酶抑制剂PMSF(Sigma-Aldrich,USA)的RIPA缓冲液(Beyotime Biotechnology, Bei‐ jing)裂解以获取组织匀浆,超声后于4 ℃下12 000 r/min离心20 min,收集上清液。将蛋白质样品在SDS-PAGE凝胶上分离,转移到PVDF膜上,后续使用5% 脱脂牛奶封闭。使用以下抗体在4 ℃下孵育过夜:anti-NFATc1、anti-c-fos、anti-TRAP、anti-CTSK、anti-TNF- α、anti- β -actin、anti-RANKL、anti-RANK、anti-TRAF6、anti-p-P65、anti- P65、anti-IκBα。使用TBST缓冲液冲洗后,用酶标山羊抗兔二抗(1∶2 000)室温孵育1 h。使用近红外荧光成像系统对目标蛋白条带进行可视化。每个蛋白进行3个重复并使用Image J软件测量蛋白条带的强度。
1.8 肠道微生物测序
考虑到高剂量的买麻藤醇较低剂量买麻藤醇具有更好的抗炎活性和抗骨丢失作用,因此在肠道菌群测序中治疗组为高剂量买麻藤醇组。按照说明书使用TGuide S96磁性土壤/粪便DNA试剂盒〔天根生物科技(北京)有限公司〕从粪便样品中提取总基因组DNA。扩增细菌16S rRNA基因的高变区V3-V4所用引物对为338 F:5’-ACTCCTACGGGAGGCAGCA-3’和806 R:5’-GGACTACHVGGGTWTCTAAT-3’。在琼脂糖凝胶上检查PCR产物,并通过Omega DNA纯化试剂盒(Omega Inc.,Nor‐ cross,GA,USA)纯化。收集纯化的PCR产物,并在Illumina Novaseq 6000平台上进行配对末端(2× 250 bp)。使用USEARCH(10.0版)将相似度阈值超过97% 的合格序列分配给一个业务分类单元(OTU)。使用SILVA数据库[13](138.1版),基于QIIME2中的Naive Bayes分类器[14]对OTU/ASV进行分类注释,置信度阈值为70%。使用QIIME2软件进行α分析,以确定每个样品的物种多样性复杂性。通过主成分分析(PCA)β多样性计算,以评估样本中物种复杂性的多样性。采用单因素方差分析比较细菌丰度和多样性。线性判别分析(LDA)与效应大小(LEfSe)相结合,评价差异丰度分类群。使用在线平台BMKCloud(https://www.biocloud.net)分析测序数据。
1.9 统计学方法
使用SPSS 23.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析加Tukey检验,以P<0.05为差异具有统计学意义。除另有说明,本研究所有数据均代表至少3次重复进行的实验结果。
2. 结果
2.1 买麻藤醇减轻骨质疏松性骨缺损中的骨质流失
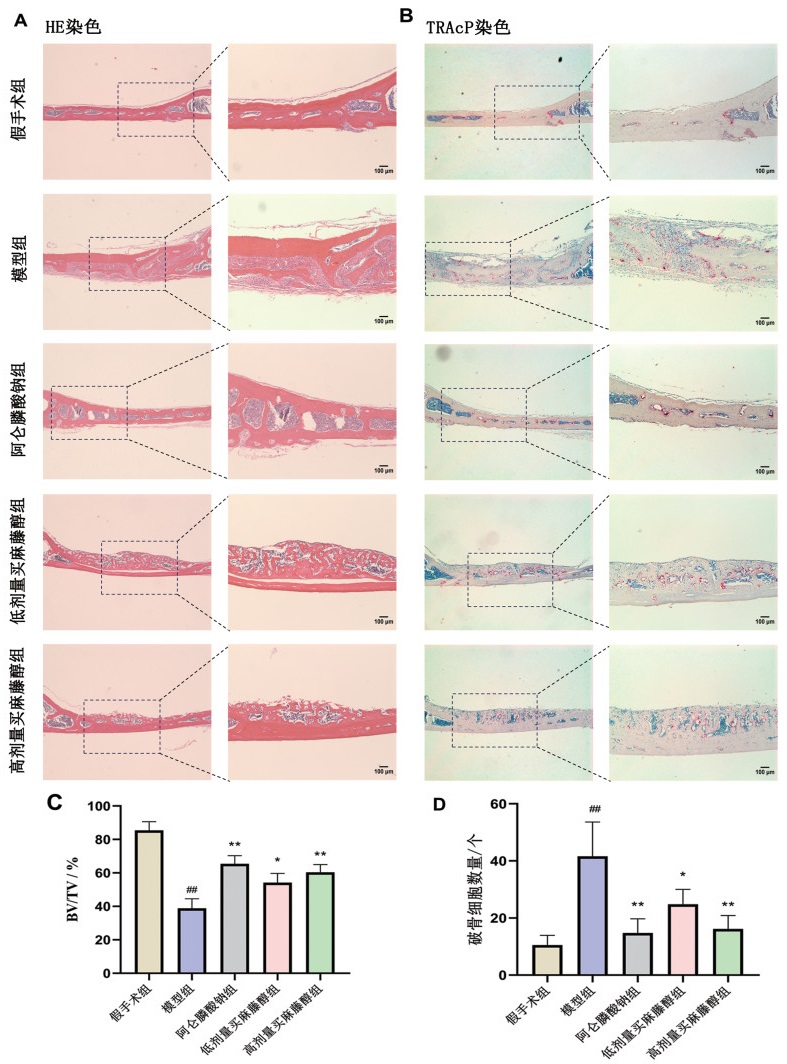
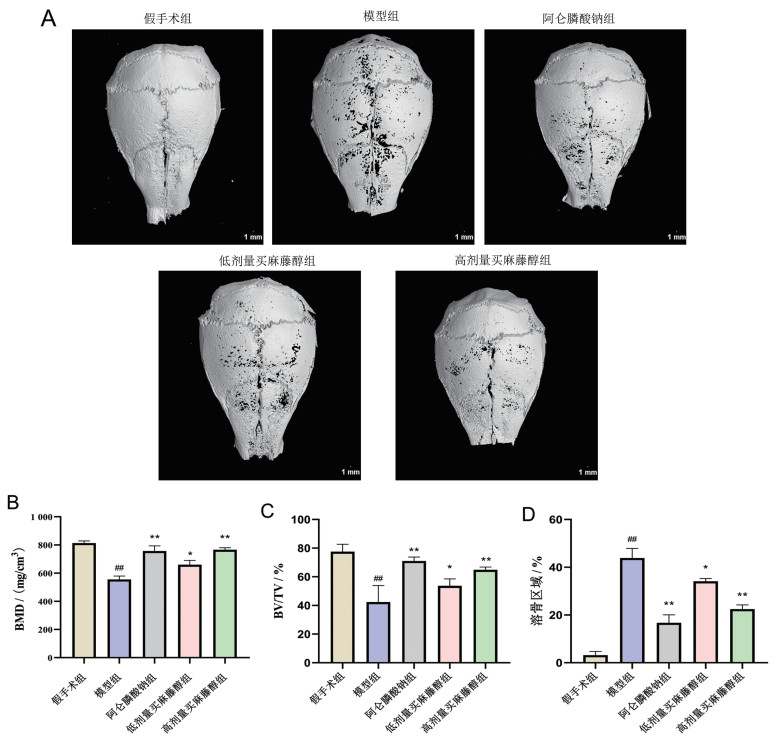
使用Micro-CT成像技术对小鼠颅骨结构进行分析。对颅骨结构的评估显示,模型组颅骨注射LPS后14 d出现大面积骨质破坏,骨体积减少,骨质孔隙度增加,买麻藤醇可逆转骨质疏松状态下LPS诱导的炎性骨缺损症状。买麻藤醇具有和阿仑膦酸钠相类似的作用,均可提高骨质疏松性炎性骨缺损小鼠的骨密度(BMD)、骨体积/总体积(BV/TV)Micro-CT指标,并降低LPS导致的骨溶解面积(P<0.05),见图 1。
对颅骨做HE染色可见,模型组骨小梁完整性受到破坏,受损部位有大量的炎症细胞浸润和胶原纤维,买麻藤醇可使受损的骨小梁结构得到修复,减少炎症细胞的浸润(图 2A、图 2C)。颅骨TRAcP染色图像显示,模型组破骨细胞数量高于假手术组,买麻藤醇和阿仑膦酸钠均降低了颅骨表面破骨细胞的数量,高剂量买麻藤醇组较低剂量显示出更强的抑制破骨细胞活性,表明买麻藤醇对破骨细胞的抑制作用呈剂量依赖性(图 2B、图 2D)。
2.2 买麻藤醇调节骨质疏松性骨缺损小鼠的骨代谢失衡
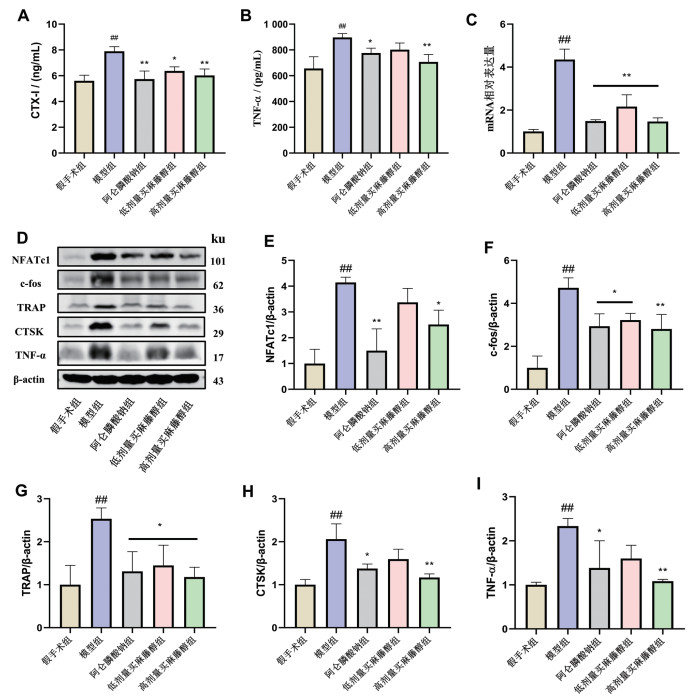
通过ELISA检测骨吸收标志物CTX-I与促进破骨细胞生成的炎症因子TNF-α浓度。与假手术组比较,模型组CTX-I和TNF-α浓度显著提高(P<0.05);与模型组相比,买麻藤醇和阿仑膦酸钠组CTX-I(P<0.05)和TNF-α(P<0.05)血清浓度降低,高剂量买麻藤醇组抑制效果更强(图 3A、图 3B)。与假手术组相比,模型组调控破骨细胞标志物CTSK的mRNA表达提高;买麻藤醇和阿仑膦酸钠显著降低了CTSK的mRNA表达(图 3C)。买麻藤醇呈剂量依赖性抑制介导破骨细胞分化的TNF-α和破骨细胞主转录因子NFATc1与c-fos的蛋白表达,并抑制介导的骨吸收的两个酶CTSK和TRAP的蛋白表达(图 3D~图 3I)。
![]() 图 3 买麻藤醇对炎性细胞因子、破骨细胞标志物和破骨细胞转录因子的影响A:各组破骨细胞标志物的血清CTX-I水平比较(n=5);B:各组炎症标志物的血清TNF-α水平比较(n=5);C:各组破骨细胞标志物CTSK的mRNA水平比较(n=3);D:小鼠胫骨中NFATc1、c-fos、TRAP、CTSK、TNF-α和β-actin的western blotting图(n=3);E~I:各组NFATc1/β-actin、c-fos/β-actin、TRAP/β-actin、CTSK/β-actin、TNF-α/β-actin的比率比较(n=3);与假手术组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
图 3 买麻藤醇对炎性细胞因子、破骨细胞标志物和破骨细胞转录因子的影响A:各组破骨细胞标志物的血清CTX-I水平比较(n=5);B:各组炎症标志物的血清TNF-α水平比较(n=5);C:各组破骨细胞标志物CTSK的mRNA水平比较(n=3);D:小鼠胫骨中NFATc1、c-fos、TRAP、CTSK、TNF-α和β-actin的western blotting图(n=3);E~I:各组NFATc1/β-actin、c-fos/β-actin、TRAP/β-actin、CTSK/β-actin、TNF-α/β-actin的比率比较(n=3);与假手术组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01。2.3 买麻藤醇通过RANKL/RANK/TRAF6通路抑制NF-κB信号通路
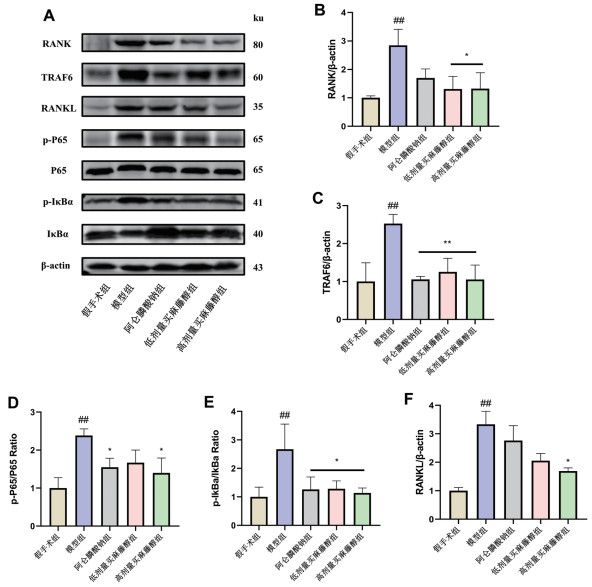
Western blotting检测分析显示,与假手术组比较,模型组RANKL、RANK和TRAF6表达升高,P65和IκBα的磷酸化表达上升(图 4),买麻藤醇呈剂量依赖性抑制了RANKL、RANK和TRAF6的蛋白表达,并降低P65和IκBα的磷酸化表达,且高剂量组较低剂量组强。
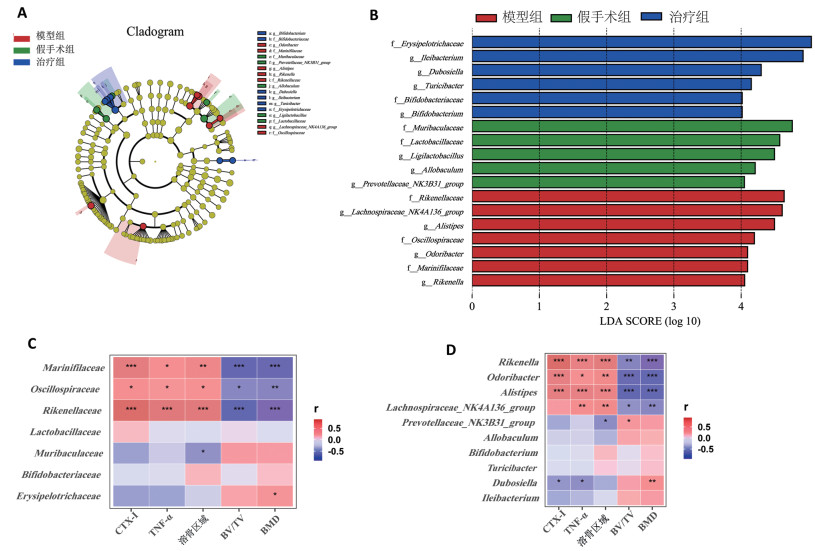
2.4 买麻藤醇恢复骨质疏松性骨缺损小鼠的肠道微生物平衡
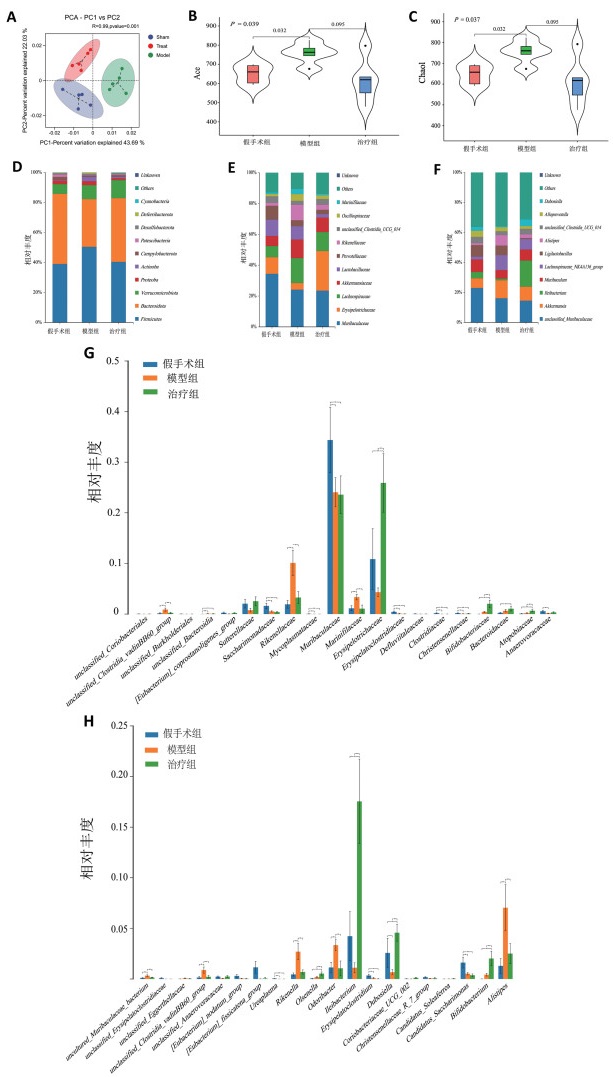
通过检测各组粪便中V3~V4可变区的16SrRNA基因来评估各处理因素对肠道微生物的改变。PCA图显示,假手术组和模型组分群有显著区别,而与治疗组有部分重叠(图 5A);模型组的Ace和Chao1指数较假手术组提高,差异有统计学意义(图 5 B、图 5C)。
为研究肠道菌群的具体变化,选取丰度前10的门、科和属水平的物种绘制聚类直方图以直观显示各处理组中科和属水平的肠道微生物群变化(图 5D ~图 5E)。门水平上买麻藤醇提高拟杆菌门的丰度(图 5 D);在科水平上,买麻藤醇逆转因OVX和LPS导致的丹毒丝菌科、未分类梭菌丰度下降和毛螺菌属、阿克曼菌、理研菌科和颤螺菌属的升高(图 5E、图 5G);在属水平上模型组的阿克曼菌、毛螺菌属和另枝菌属丰度高于假手术组,而在治疗组中这些属丰度下降。对于在模型组中丰度降低的属,在治疗组中也能够得到提高(回肠杆菌属、Muribaculum、未分类梭菌、杜博菌属)(图 5F、图 5H)。
为了进一步确定模型组和治疗组中肠道菌群组成和结构的改变,在科和属水平上进一步进行LDA和LEfSe分析,以找出与模型组、治疗组相关的细菌分类学标记。经过OVX和LPS的处理,发现模型组理研菌科(包括理研菌属)、毛螺菌属_NK4A136_group、另枝菌属、颤螺菌科(包括颤螺菌属)和Marinifilaceae富集。在治疗组中发现丹毒丝菌科、双歧杆菌科(包括双歧杆菌属)、回肠杆菌属、杜博菌属和苏黎世杆菌属显著富集(图 6A、图 6B)。通过Perason相关性分析发现,模型组的生物标志菌〔文肯菌科(包括文肯菌属)、颤螺菌科(包括颤螺菌属)和Marinifilaceae)〕与BMD和BV/TV呈负相关关系,而与溶骨区域、CTX-I和TNF-α呈正相关关系;治疗组生物标志菌丹毒丝菌科与BMD呈正相关关系,杜博菌属与CTX-I和TNF-α呈负相关关系,与BMD呈正相关关系(图 6 C、图 6D)。
3. 讨论
目前已从买麻藤属植物中提取出的化合物包括白藜芦醇、买麻藤醇、原儿茶酸甲酯、原儿茶酸、香草醛、阿魏酸等[15]。然而,除了白藜芦醇、香草醛、阿魏酸在骨质疏松方面有部分研究外[16-18],其余化合物在骨流失或骨缺损相关疾病上的作用尚未见相关研究报道。本研究结果表明,买麻藤醇可有效抑制骨质疏松状态下LPS导致的颅骨缺损现象。对买麻藤醇抗骨质疏松性骨缺损作用的进一步研究发现,其对RANKL/RANK/TRAF6信号通路和NF-κB信号通路有一定的抑制作用,并降低了上述信号通路介导的破骨细胞转录因子c-fos和NFATc1和骨吸收相关酶CTSK和TRAP的表达。该研究发现解释了买麻藤醇所具有的抗骨质疏松性骨缺损作用,同时这也是首次在动物实验上发现可对RANKL/RANK/TRAF6信号通路起到一定抑制作用的芪类化合物,充分证明了买麻藤属植物在预防和治疗骨质流失相关疾病方面的巨大潜力,未来可对该属植物的药理特性做进一步的研究。与此同时,我们与临床常用的抗骨质疏松药物阿仑膦酸钠的抗骨丢失作用做比较,发现高剂量的买麻藤醇在促进缺损部位的重建、抑制骨吸收转录因子和相关酶方面与阿仑膦酸钠疗效相近,且对炎症因子TNF- α有较强的抑制作用,这是阿仑膦酸钠未能达到的效果,充分证实了天然产物在抗骨丢失疾病方面的优势。
肠—骨轴的发现为骨流失相关疾病的发病机制和治疗提供了新的视角。目前认为肠道菌群紊乱可导致促炎反应的有害菌丰度增加而有益菌减少[19],从而导致破骨细胞分化增强。在本研究中,我们发现模型组有害菌为该组的优势菌,如理研菌科(包括理研菌属)和毛螺菌属NK4A136_group。流行病学数据表明,理研菌科已被发现在低BMD组和高TRACP-5b人群中更为丰富[20],Perason相关性分析发现,理研菌科与BMD呈负相关关系,因此有理由认为理研菌科参与到骨流失的发病机制中。有研究发现,毛螺菌属NK4A136_group与肠道炎症反应相关[21],Perason相关性分析发现该属与炎症因子TNF-α呈显著正相关关系。上述研究结果表明,模型组的优势菌参与到骨流失和炎症反应中,对骨质疏松性骨缺损的发生起到一定的促进作用。经过高剂量买麻藤醇的治疗,理研菌科和毛螺菌属NK4A136_group的丰度得到有效的下降,同时该组的优势菌群对炎症反应和骨流失有一定的抑制作用。有研究发现,丹毒丝菌科与大鼠的BMD呈正相关关系[22],本研究的Pearson相关性分析也得到同样结论,杜博菌属和双歧杆菌属被认为可修复肠道屏障并调节炎症反应,公认的有益菌双歧杆菌属可抑制TNF-α/NF-κB信号通路,减少炎症介质的产生并阻断炎症介质的激活,从而阻止破骨细胞的生成[23]。因此,丹毒丝菌科、杜博菌属和双歧杆菌属可能是买麻藤醇抗骨质疏松性骨缺损的关键菌群。
综上所述,买麻藤醇可有效改善骨质疏松性骨缺损的骨微结构破坏,其机制与抑制RANKL/ RANK/TRAF6信号通路和调控肠道菌群有益菌和有害菌丰度相关。
-
图 3 买麻藤醇对炎性细胞因子、破骨细胞标志物和破骨细胞转录因子的影响
A:各组破骨细胞标志物的血清CTX-I水平比较(n=5);B:各组炎症标志物的血清TNF-α水平比较(n=5);C:各组破骨细胞标志物CTSK的mRNA水平比较(n=3);D:小鼠胫骨中NFATc1、c-fos、TRAP、CTSK、TNF-α和β-actin的western blotting图(n=3);E~I:各组NFATc1/β-actin、c-fos/β-actin、TRAP/β-actin、CTSK/β-actin、TNF-α/β-actin的比率比较(n=3);与假手术组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
-
[1] AVGERINOU C, PETERSEN I, CLEGG A, et al. Trends in incidence of recorded diagnosis of osteoporosis, osteopenia, and fragility fractures in people aged 50 years and above: retrospective cohort study using UK primary care data[J]. Osteoporosis international : a journal established as result of cooperation between the European foundation for osteoporosis and the national osteoporosis Foundation of the USA, 2023, 34(8): 1411-1427. doi: 10.1007/s00198-023-06739-1
[2] 汤淑女, 尹香君, 余卫, 等. 中国40岁及以上绝经后女性骨质疏松症患病率及其影响因素研究[J]. 中华流行病学杂志, 2022, 43(4): 509-516. [3] NIH CONSENSUS DEVELOPMENT PANEL ON OSTEOPOROSIS PREVENTION, DIAGNOSIS, AND THERAPY. Osteoporosis prevention, diagnosis, and therapy[J]. JAMA, 2001, 285: 785-795. doi: 10.1001/jama.285.6.785
[4] REID I R, BILLINGTON E O J T L. Drug therapy for osteoporosis in older adults[J]. Lancet, 2022, 399(10329): 1080-1092. doi: 10.1016/S0140-6736(21)02646-5
[5] REMSBERG C M, MARTINEZ S E, AKINWUMI B C, et al. Preclinical pharmacokinetics and pharmacodynamics and content analysis of gnetol in foodstuffs[J]. Phytotherapy research, 2015, 29(8): 1168-1179. doi: 10.1002/ptr.5363
[6] XIANG W, JIANG B, LI X M, et al. Constituents of Gnetum montanum[J]. Fitoterapia, 2002, 73(1): 40-42. doi: 10.1016/S0367-326X(01)00370-7
[7] SERMBOONPAISARN T, SAWASDEE P. Potent and selective butyrylcholinesterase inhibitors from ficus foveolata[J]. Fitoterapia, 2012, 83(4): 780-784. doi: 10.1016/j.fitote.2012.03.009
[8] AKINWUMI B C, BORDUN K-A M, ANDERSON HDJIJOMS. Biological activities of stilbenoids[J]. International journal of molecular sciences, 2018, 19(3): 792. doi: 10.3390/ijms19030792
[9] DVORAKOVA M, LANDA P J P R. Anti-inflammatory activity of natural stilbenoids: A review[J]. Pharmacological research, 2017, 124: 126-145. doi: 10.1016/j.phrs.2017.08.002
[10] JINADATTA P, RAJSHEKARAPPA S, SUNDERA RAJA RAO K, et al. In silico, in vitro: antioxidant and antihepatotoxic activity of gnetol from gnetumula brongn[J]. BioImpacts, 2019, 9(4): 239-249. doi: 10.15171/bi.2019.29
[11] HORNEDO-ORTEGA R, JOURDES M, DA COSTA G, et al. Oxyresveratrol and gnetol glucuronide metabolites: chemical production, structural identification, metabolism by human and rat liver fractions, and in vitro antiinflammatory properties[J]. Journal of agricultural and food chemistry, 2022, 70(41): 13082-13092. doi: 10.1021/acs.jafc.1c07831
[12] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020. [13] QUAST C, PRUESSE E, YILMAZ P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic acids research, 2013, 41(Database issue): D590-D596. http://nar.oxfordjournals.org/content/41/D1/D590.full-text-lowres.pdf
[14] BOLYEN E, RIDEOUT J R, DILLON M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QⅡME 2[J]. Nature biotechnology, 2019, 37(8): 852-857. doi: 10.1038/s41587-019-0209-9
[15] 陈丽君. 垂子买麻藤中抗菌化学成分的再研究[J]. 药学进展, 2014, 38(8): 597-601. [16] DOSS H M, SAMARPITA S, GANESAN R, et al. Ferulic acid, a dietary polyphenol suppresses osteoclast differentiation and bone erosion via the inhibition of RANKL dependent NF- κB signalling pathway[J]. Life sciences, 2018, 207: 284-295. doi: 10.1016/j.lfs.2018.06.013
[17] CHEN Y, DOU C, YI J, et al. Inhibitory effect of vanillin on RANKL-induced osteoclast formation and function through activating mitochondrial-dependent apoptosis signaling pathway[J]. Life sciences, 2018, 208: 305-314. doi: 10.1016/j.lfs.2018.07.048
[18] LI J, LI L, WU T, et al. An injectable thermosensitive hydrogel containing resveratrol and dexamethasone-loaded carbonated hydroxyapatite microspheres for the regeneration of osteoporotic bone defects[J]. Small methods, 2024, 8(1): e2300843. doi: 10.1002/smtd.202300843
[19] HAO M L, WANG G Y, ZUO X Q, et al. Gut microbiota: an overlooked factor that plays a significant role in osteoporosis[J]. Journal of international medical research, 2019, 47(9): 4095-4103. doi: 10.1177/0300060519860027
[20] OZAKI D, KUBOTA R, MAENO T, et al. Association between gut microbiota, bone metabolism, and fracture risk in postmenopausal Japanese women[J]. Osteoporosis international : a journal established as result of cooperation between the European foundation for osteoporosis and the national osteoporosis foundation of the USA, 2021, 32(1): 145-156. doi: 10.1007/s00198-020-05728-y
[21] WU X, XU N, YE Z, et al. Polysaccharide from Scutellaria barbata D. Don attenuates inflammatory response and microbial dysbiosis in ulcerative colitis mice[J]. International journal of biological macromolecules, 2022, 206: 1-9. doi: 10.1016/j.ijbiomac.2022.02.119
[22] LU Y, YANG J, DONG C, et al. Gut microbiome-mediated changes in bone metabolism upon infrared light exposure in rats[J]. Journal of photochemistry and photobiology B, biology, 2021, 217: 112-156.
[23] WU Y, YANG Y, WANG L, et al. Effect of Bifidobacterium on osteoclasts: TNF- α/NF- κB inflammatory signal pathway-mediated mechanism[J]. Frontiers in endocrinology, 2023, 14: 1109296. doi: 10.3389/fendo.2023.1109296





 下载:
下载: